Hai Sobat Latis Kelas 10!
Pernah nggak sih kamu merasa penasaran, sebenarnya benda-benda di sekitarmu, mulai dari udara yang kamu hirup, gadget yang kamu pegang, sampai dirimu sendiri, terbuat dari apa? Jawaban dasarnya adalah atom!
Atom adalah partikel penyusun segala materi, tapi nggak bisa dilihat mata telanjang. Nah, di pelajaran Kimia kelas 10, kamu bakal berkenalan dengan konsep dasar Struktur Atom. Jangan bayangin ini materi rumit ya!
Memahami struktur atom itu seperti punya kunci untuk membuka pemahaman tentang sifat materi, reaksi kimia, bahkan teknologi modern. Yuk, kita selami dunia kecil yang super penting ini!
Baca juga: intensif utbk

Anatomi Atom: Proton, Neutron, dan Elektron si Kecil yang Berjasa
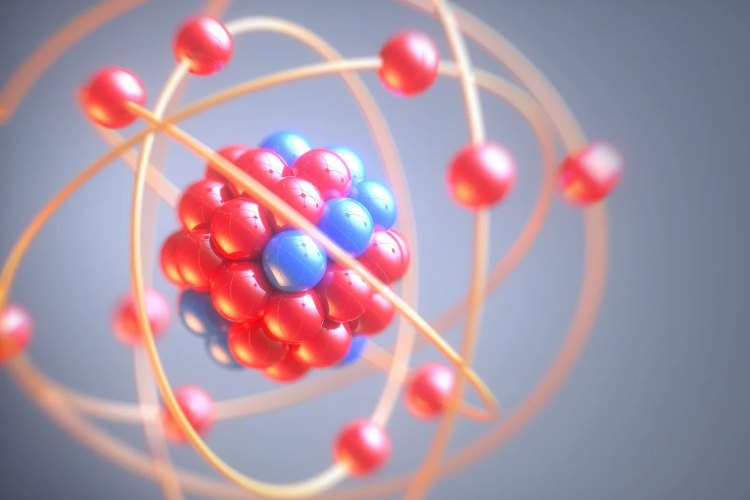
Bayangkan sebuah atom itu seperti tata surya mini. Di tengahnya ada inti atom yang sangat padat dan kecil, dikelilingi oleh elektron yang bergerak sangat cepat di ruang tertentu di sekitarnya. Inti atom sendiri terdiri dari dua jenis partikel subatom.
-
Proton
-
Bermuatan positif (+1)
-
Memiliki massa relatif besar (ditetapkan sebagai 1 satuan massa atom – sma).
-
Jumlah proton menentukan identitas sebuah atom. Inilah yang disebut Nomor Atom (Z). Misalnya, semua atom yang punya 1 proton pasti adalah atom Hidrogen (H), yang punya 6 proton pasti Karbon (C), dan seterusnya.
-
Neutron
-
Bermuatan netral (0)
-
Memiliki massa yang hampir sama dengan proton (juga sekitar 1 sma).
-
Neutron bertindak seperti “lem” yang membantu mengikat proton-proton dalam inti. Jumlah neutron memengaruhi stabilitas inti dan menentukan isotop suatu unsur. Atom dengan nomor atom sama tapi massa berbeda? Itu karena jumlah neutronnya beda!
-
Elektron
-
Bermuatan negatif (-1)
-
Memiliki massa yang sangat kecil (sekitar 1/1840 massa proton, sering dianggap nol).
-
Elektron bergerak di luar inti, menempati wilayah yang disebut kulit atom atau orbital. Perilaku elektron inilah yang paling bertanggung jawab atas sifat kimia suatu unsur (bagaimana unsur itu bereaksi dengan unsur lain). Dalam atom netral, jumlah elektron sama dengan jumlah proton (Nomor Atom).
Kesimpulan Penting:
-
Nomor Atom (Z) = Jumlah Proton = Jumlah Elektron (pada atom netral)
-
Nomor Massa (A) = Jumlah Proton + Jumlah Neutron
-
Jumlah Neutron = A – Z
Contoh:
Atom Karbon (C) punya nomor atom 6 dan nomor massa 12. Itu berarti bahwa:
-
Jumlah Proton = 6
-
Jumlah Elektron = 6 (karena atom netral)
-
Jumlah Neutron = 12 – 6 = 6
Baca juga: tutor private
Konfigurasi Elektron: Denah Rumah si Elektron dan Kaitannya dengan Sifat Kimia
Kamu sudah tahu elektron bergerak mengelilingi inti, tapi nggak sembarangan! Mereka menempati wilayah-wilayah tertentu yang disebut kulit atom (dilambangkan dengan n=1, 2, 3, dst., atau huruf K, L, M, dst.). Kulit yang dekat inti (n kecil) punya energi lebih rendah, kulit yang jauh (n besar) punya energi lebih tinggi.
Konfigurasi Elektron adalah cara menggambarkan bagaimana elektron-elektron tersebut tersebar di berbagai kulit atom. Mengapa ini penting? Karena elektron di kulit terluar (elektron valensi) sangat menentukan sifat kimia suatu unsur!
Aturan Pengisian Elektron (Prinsip Aufbau)
Elektron mengisi kulit/subkulit yang tingkat energinya paling rendah dulu. Kapasitas maksimum tiap kulit adalah:
-
Kulit K (n=1): Maksimal 2 elektron
-
Kulit L (n=2): Maksimal 8 elektron
-
Kulit M (n=3): Maksimal 18 elektron
-
Kulit N (n=4): Maksimal 32 elektron
-
… dan seterusnya (2n²)
Cara Menulis Konfigurasi Elektron
-
Tentukan Nomor Atom (Z) = Jumlah Elektron.
-
Isi elektron mulai dari kulit terdekat inti (K) sampai habis, sesuai kapasitas maksimumnya.
Contoh 1: Natrium (Na) – Z = 11
-
Kulit K: 2 elektron
-
Kulit L: 8 elektron
-
Kulit M: 1 elektron (sisanya, karena 2+8=10, masih kurang 1 dari 11)
-
Konfigurasi: 2 . 8 . 1 atau K-2, L-8, M-1
Contoh 2: Klorin (Cl) – Z = 17
-
Kulit K: 2
-
Kulit L: 8
-
Kulit M: 7 (2+8=10, 17-10=7)
-
Konfigurasi: 2 . 8 . 7 atau K-2, L-8, M-7
Baca juga: les privat terbaik
Elektron Valensi & Sifat Kimia
Elektron Valensi adalah jumlah elektron di kulit terluar.
-
Na: Kulit terluar M, berisi 1 elektron → Elektron Valensi = 1
-
Cl: Kulit terluar M, berisi 7 elektron → Elektron Valensi = 7
Unsur-unsur dengan elektron valensi sama cenderung memiliki sifat kimia yang mirip!
Unsur berusaha mencapai kestabilan seperti gas mulia (elektron valensi 8, kecuali He=2). Caranya dengan melepas, menangkap, atau berbagi elektron valensi. Inilah dasar ikatan kimia!
-
-
Na (valensi 1) cenderung melepas 1 elektron menjadi Na⁺.
-
Cl (valensi 7) cenderung menangkap 1 elektron menjadi Cl⁻.
-
Na⁺ dan Cl⁻ tarik-menarik membentuk senyawa NaCl (garam dapur).
-
Baca juga: intensif utbk

Atom dan Sistem Periodik Unsur: Peta Rahasia Kimia
Sistem Periodik Unsur (SPU) bukan sekadar tabel biasa! Ini adalah peta raksasa yang mengatur semua unsur kimia berdasarkan nomor atom (Z) dan menunjukkan pola sifat-sifat unsur secara periodik (berulang).
Hubungan Struktur Atom dengan SPU
1. Nomor Atom (Z) = Posisi Unsur
Unsur disusun dalam SPU berdasarkan kenaikan nomor atom. Ini juga berarti kenaikan jumlah proton dan elektron.
2. Periode (Baris Horizontal)
-
-
Menunjukkan jumlah kulit atom yang terisi elektron.
-
Periode 1: Hanya kulit K (max 2 unsur: H, He)
-
Periode 2: Kulit K dan L terisi (8 unsur: Li s/d Ne)
-
Periode 3: Kulit K, L, M terisi (8 unsur: Na s/d Ar)
-
… dst.
-
Semakin ke bawah periode, jumlah kulit semakin banyak, jari-jari atom semakin besar.
-
3. Golongan (Kolom Vertikal)
-
-
Menunjukkan jumlah elektron valensi.
-
Golongan IA (Alkali): Elektron valensi = 1 (Contoh: Li, Na, K)
-
Golongan IIA (Alkali Tanah): Elektron valensi = 2 (Contoh: Be, Mg, Ca)
-
Golongan VIIA (Halogen): Elektron valensi = 7 (Contoh: F, Cl, Br)
-
Golongan VIIIA (Gas Mulia): Elektron valensi = 8 (sudah stabil) (Contoh: Ne, Ar, Kr)
-
Unsur dalam satu golongan memiliki sifat kimia yang sangat mirip karena elektron valensinya sama!
-
Perubahan Sifat dalam SPU:
-
Jari-jari Atom: Dalam satu periode (kiri ke kanan), jari-jari atom cenderung mengecil (karena muatan inti efektif meningkat, menarik elektron lebih kuat). Dalam satu golongan (atas ke bawah), jari-jari atom membesar (karena jumlah kulit bertambah).
-
Energi Ionisasi (EI): Energi yang dibutuhkan untuk melepaskan 1 elektron terluar. Dalam satu periode (kiri ke kanan), EI cenderung meningkat (karena jari-jari kecil, elektron terikat kuat). Dalam satu golongan (atas ke bawah), EI cenderung menurun (karena jari-jari besar, elektron terluar lebih mudah lepas).
-
Keelektronegatifan: Kemampuan atom menarik elektron dalam ikatan kimia. Polanya mirip EI: dalam satu periode meningkat (kiri ke kanan), dalam satu golongan menurun (atas ke bawah). Paling elektronegatif: Fluor (F).
Mengapa SPU Penting?
Dengan memahami posisi unsur di SPU, kamu bisa memprediksi:
- Nomor atom dan nomor massanya (relatif).
- Jumlah proton, neutron (jika isotop diketahui), dan elektron.
- Konfigurasi elektron dan elektron valensinya.
- Jenis ion yang akan terbentuk (positif atau negatif).
- Sifat kimianya (logam, nonlogam, metaloid; reaktif atau stabil).
- Jenis senyawa yang mungkin dibentuk.
Baca juga: bimbel sbmptn
Nah, sekarang kamu sudah punya gambaran dasar tentang struktur atom dan betapa pentingnya konsep ini dalam ilmu Kimia, terutama untuk kelas 10. Ingat tiga pilar utamanya yaitu komponen penyusun atom (proton, neutron, elektron), konfigurasi elektron (terutama elektron valensi), dan hubungannya yang erat dengan Sistem Periodik Unsur (SPU).
Dengan memahami nomor atom, kamu tahu identitas unsur. Dengan memahami konfigurasi elektron, kamu bisa memprediksi bagaimana unsur itu akan bereaksi. Dan dengan memahami SPU, kamu punya peta untuk melihat pola sifat semua unsur secara sistematis.
Memang butuh latihan untuk benar-benar mahir, tapi konsep dasar ini adalah fondasi yang kokoh untuk memahami bab-bab Kimia selanjutnya, mulai dari ikatan kimia, stoikiometri, sampai termokimia.
Jadi, jangan menyerah! Jika kamu membutuhkan bantuan, kamu bisa klik website kami di www.tutorIndonesia.co.id untuk mendapatkan info seputar pelajaran IPA lainnya. Atau kamu juga bisa tanya-tanya CS kami di (021) 77844897 dan 087781609961 untuk sesi konsultasi.
Selamat belajar dan menjelajahi dunia menakjubkan atom-atom penyusun alam semesta!
Referensi:
https://repositori.kemendikdasmen.go.id/22169/1/X_Kimia_KD-3.2_Final.pdf
https://mamikos.com/info/materi-struktur-atom-konfigurasi-elektron-kelas-10-sma-pljr/
https://www.zenius.net/blog/materi-kimia-struktur-atom/
https://akupintar.id/belajar/-/online/materi/10-mia/kimia/struktur-atom-dan-sistem-periodik-unsur/413521



